
کاتالیست سنتر متانول یکی از پیشرفته ترین کاتالیست های صنعت به شمار می رود که در مجتمع های پتروشیمی پس از تولید گاز سنتز از گاز متان، برای تبدیل گاز سنتز به متانول از کاتالیست استراتژیک سنتز متانول استفاده می شود. مقاله حاضر کاتالسیت سنتز متانول را به لحاظ مشخصات فیزیکی، شیمیایی و عملکردی در صنایع پتروشیمی معرفی میکند.
متانول با فرمول شیمیایی CH۳OH، ترکیبی بیرنگ و بیبو و سادهترین عضو خانواده الکلها است. متانول برای اولین بار در سال ۱۶۶۱ به همت رابرت بویل از تقطیر چوب به دست آمد و نام آن را «عصاره چوب» نهاد. ماهیت شیمیایی متانول یا فرمول شیمیایی آن یعنی CH۳OH در سال ۱۸۳۴ از سوی جِن باپتیست و دوماس و ایگن پی لیگوت ارائه شد. این ترکیب یکی از ۱۰ ماده شیمیایی پر مصرف جهان است.
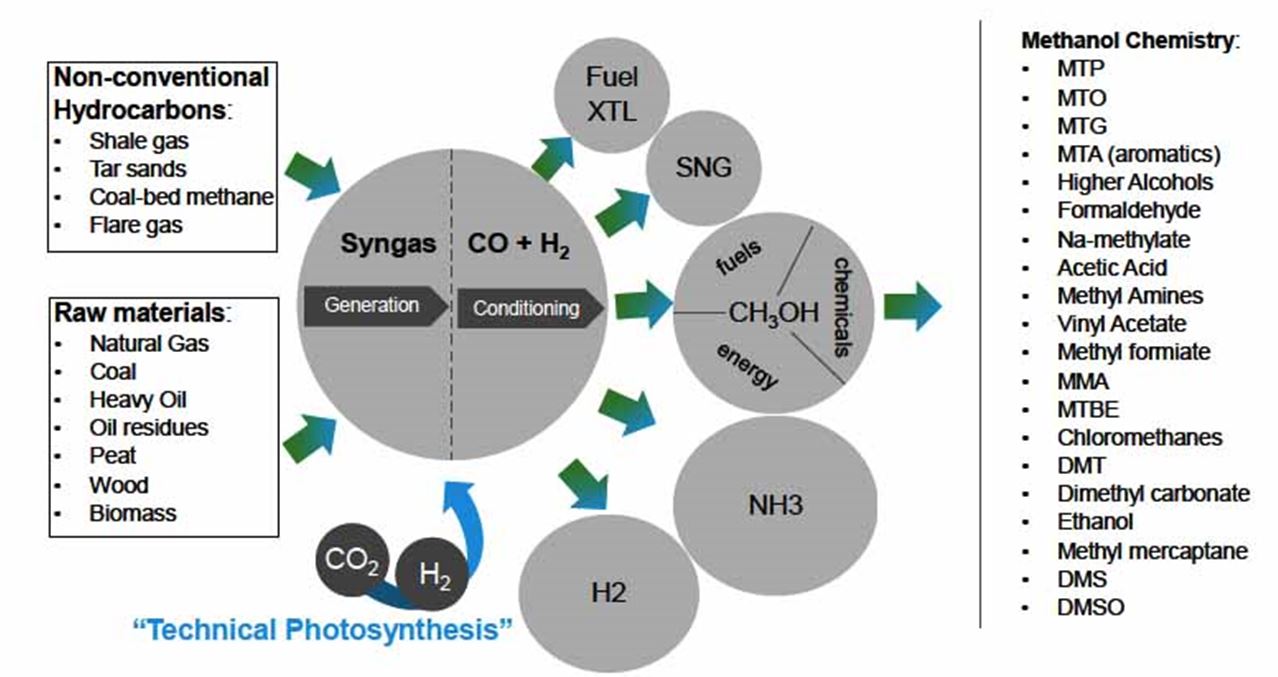
متانول ماده اولیه بسیاری از مواد شیمیایی دیگر است که طی فرایندهای ثانویه به مواد اولیه مورد استفاده در صنایع پایین دستی تبدیل میشود. این موضوع در شکل زیر مشاهده میشود. همانطور که در شکل زیر (چرخه تولید و مصرف متانول از مواد اولیه تا محصولات) مشاهده میشود بالغ بر ۱۸ نوع ماده شیمیایی از متانول مشتق میشود که مهمترین آنها فرمالدهید و اسید استیک هستند.
تا سال ۱۹۲۰، چوب تنها منبع تامین متانول بود و در این فرایند به ازای یک تن چوب حدود ۱۰ الی ۲۰ لیتر متانول به دست میآید. در آغاز دهه ۱۸۳۰، متانول به عنوان سوخت برای گرمایش و پخت و پز استفاده میشد که بعدها با سوخت ارزانتر نظیر نفت سفید جایگزین شد. در طول جنگ جهانی اول متانول همرا با استون و برخی مواد شیمیایی دیگر از خروجی کورههای زغال سنگ به دست میآمد و به تدریج با توسعه صنایع چوب با زغال سنگ جایگزین شد. فرایند تولید گاز سنتز از کک و زغال سنگ در واکنش با بخار آب منجر به استفاده از هیدروژن تولید شده در مصارف شهری گردید. ظهور این تکنولوژی باعث شد که فریتز هابر و کارل بوش هیدروژن تولید شده در این فرایند را با گاز N۲ در دما و فشار بالا وارد واکنش نموده و آمونیاک تولید نمایند. این پیشرفت منجر به توسعه تعدادی از فرایندهای شیمیایی دیگر شد که باعث شد شرایط مشابه و مواد اولیه برای سنتز متانول نیز فراهم گردد. در واقع از همان ابتدا سنتز متانول و آمونیاک بسیار به یکدیگر همبسته بودند به طوری که معمولا این دو محصول هر دو در یک واحد تولید میشدند. سنتز متانول از واکنش مونوکسید کربن و هیدروژن برای اولین بار در سال ۱۹۰۵ از سوی شیمیدان فرانسوی، پاول ساباتیر مطرح شد. پس از آن تحقیقات علمی مشخص کرد که برخی از اکسیدها میتوانند به عنوان کاتالیستهای هیدروژنزدایی استفاده شوند. برای مثال جان، بخار متانول را از روی برادههای روی یا اکسید روی عبور داد و آن را به هیدروژن و مونوکسیدکربن تبدیل نمود. پس از آن اختراعات زیادی در زمینه تبدیل گاز سنتز به مخلوط پیچیدهای از ترکیبات آلی اکسیژندار نظیر متانول در ۱۹۱۳ از سوی شرکت BASF صورت پذیرفت. این کار را میتاش و اشنایدر پیگیری کردند اما تا ۱۹۲۳ تلاشی برای تولید متانول در مقیاس انبوه صورت نگرفت.
تقریبا از آغاز ۱۹۳۰ تمامی کاتالیستهایی که شرکتهای بی اس اف، دوپونت، مونت دیسون و آی سی آی در مقیاس صنعتی استفاده میکردند، بر پایه اکسید روی پایدار شده با اکسید کروم دیرگداز بودند. ترکیب واقعی کاتالیست، به شدت به این موضوع بستگی داشت که آیا کاتالیست از طریق رسوبگیری به دست آمده یا اینکه با یک اختلاط ساده اکسیدها تهیه شده است.
اولین کاتالیست صنعتی متانول که اولین بار در سال ۱۹۲۳ استفاده شد، بر پایه مخلوطی از اکسید روی/اکسید کروم (ZnO/Cr۲O۳) بود. نتایج تحقیقاتی نشان داد که کاتالیستهای اکسید روی حاوی مس، نمونههای فعالی هستند. این موضوعی کاملا صحیح است و اگر جزء دیرگداز سومی نظیر آلومینیوم یا کروم هم به آن اضافه شود، کاتالیست از لحاظ حرارتی نیز مقاوم می شود. کاتالیستهای حاوی مس مشکوک به مسموم شدن هستند. در آن زمان گاز سنتز از واکنش آب -گاز تهیه میشد و حاوی سمومی نظیر ترکیبات گوگردی و کلردار بودند لذا کاتالیستهای مس نامطلوب بودند.
هنگامی که فرایند ریفورمینگ هیدروکربنها با بخار خوراک عاری از سموم را تولید میکرد، مزیتهای کاتالیستهای فعال مس مجددا مورد توجه قرار گرفت. به زودی اثبات شد که کاتالیست بسیار فعال اکسیدمس/اکسید روی (CuO/ZnO) مخصوصا زمانی که به آنها ارتقادهندههایی نظیر کروم یا آلومینا اضافه شود، میتواند تولید متانول را متحول کند. از جنبه اقتصادی و تقاضای روزافزون برای متانول، هرچه سریعتر به فرایندهای موثرتری نیاز بود. اولین نمونه آزمایشی صنعتی کاتالیست مس در شرکت پولیش کمیکال واقع در اوسویسیم در ۱۹۶۳ به کار گرفته شد اما موفقیتآمیز نبود. آزمایشها نشان داد که کاتالیستهای رسوبی اکسید مس – اکسید روی موجود در آن زمان، ناپایدار بوده و سریعا کلوخه شده و مسموم میشوند. فرمولاسیونهای بهتری برای تولید در مقیاس وسیع توسعه یافت و پایداری کاتالیست هم افزایش پیدا کرد. پیشرفتهای حاصل شده در تکنیکهای مشخصهیابی کاتالیستها، جزئیات ساختار و فعالیت کاتالیست را در اختیار گذاشت. نتایج نشان داد که کاتالیستهای ناپایدار حاوی بلورهای بزرگ اکسیدی بودند که در آن فلزات به طور غیر یکنواخت در سراسر کاتالیست توزیع شده بودند. کاتالیستهای بهتر باید بلورهای کوچکتری داشته باشند تا توزیع یکنواختتری حاصل شود. به زودی مشخص شد که کاتالیستهای حاوی اکسید مس/اکسید روی/آلومینا با خواص مطلوب میتوانند سنتز شود و سرانجام یک واحد بزرگ تولیدی موفق در ۱۹۶۶ تاسیس گردید. به زودی پس از معرفی کاتالیست پایدار شده با آلومینا، سایر نمونههای حاوی کروم نیز تولید شدند. فرایندهای زیادی بر پایه هردو کاتالیست از ۱۹۷۱ آغاز به فعالیت کردند و اختراعات بسیاری در آن مدت ثبت شد. گاز سنتز از منابع مختلفی نظیر ریفورمینگ گاز طبیعی یا نفتا با بخار و تبدیل نفت به گاز حاصل میشد.
امروزه تقریبا بیش از ۹۰ درصد گاز سنتز در دنیا از ریفورمینگ متان حاصل میشود که در این فرایند، گاز متان قبل از ورود به ریفورمر، گوگردزدایی میشود و کاتالیستهای سه جزئی CuO/ZnO/Al۲O۳ با فعالیت و دوام بالایی میتوانند عمل میکنند. تمام کاتالیستهای سنتز متانول از گاز سنتز، کاتالیستهای سه جزئی هستند که اختلاف آنها در میزان ترکیباتشان و طول عمر آنها است.
شیمی سنتز متانول
متانول از طریق واکنش کاتالیستی هیدروژناسیون مونوکسید و دی اکسید کربن سنتز میشود. هر دو واکنش نیز گرماده هستند:
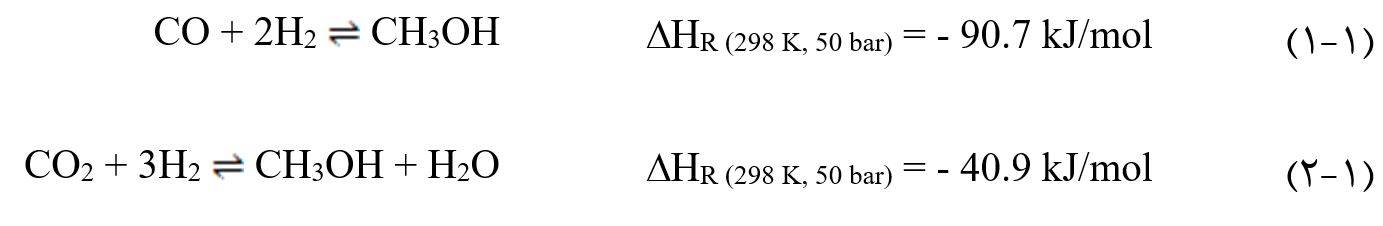
علاوه بر واکنشهای (۱-۱) و (۲-۱)، واکنش جابهجایی آب-گاز(WGS) نیز اتفاق میافتد:
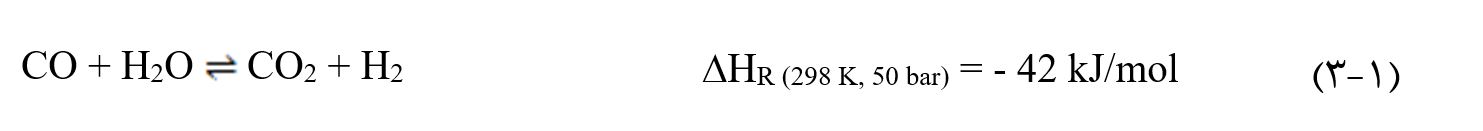
واکنشهای (۱-۱) و (۱-۲) با کاهش تعداد مول همراه هستند و واکنش (۱-۳) نیز گرمازا است و تغییری در حجم اتفاق نمیافتد. بنابراین بر طبق اصل لوشاتلیه، افزایش فشار، واکنش را به سمت تعداد مول کمتر جابهجا میکند بنابراین تولید متانول را از طریق واکنشهای (۱-۱) و (۱-۲) مطلوبتر میسازد. همچنین تولید متانول طبق اصل مذکور در دماهای پایینتر مطلوب است.
بر طبق موازنه داریم:
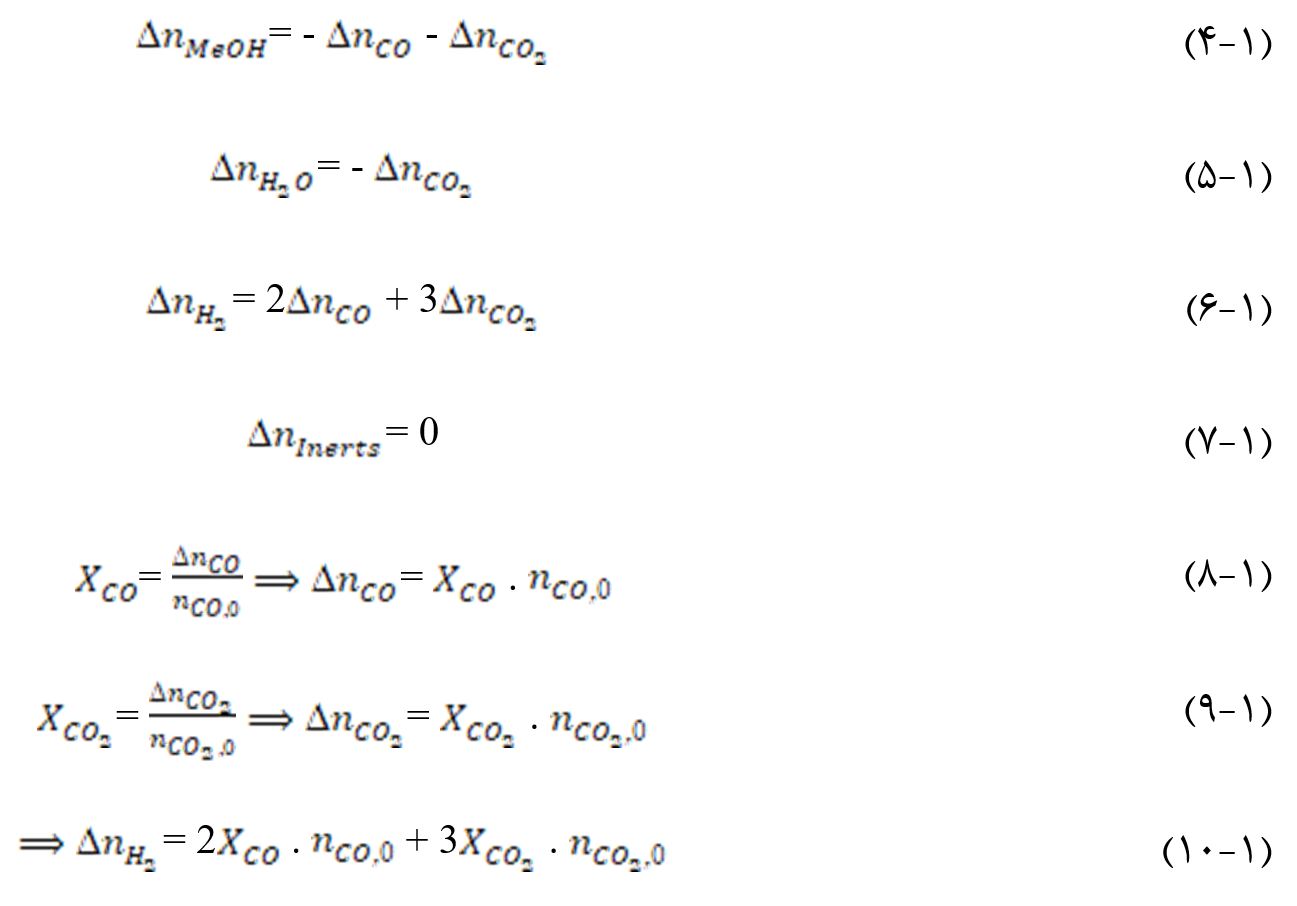
خوراک حقیقی تنها شامل CO و H۲ نیست. یک راه برای لحاظ کردن واکنش جابهجایی آب-گاز (معادله ۳-۱)،
تعریف عدد استوکیومتری(SN) است:
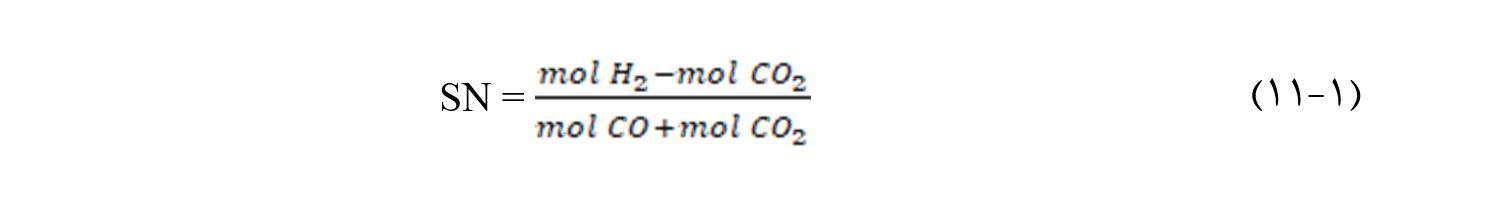
عدد استوکیومتری گاز سنتز برای تولید متانول باید ۲ باشد که با H۲/CO متفاوت است. با این حال، مقداری افزایش در میزان هیدروژن به طوری که عدد استوکیومتری به ۰۵/۲ یا حتی ۰۸/۲ برسد، میتواند منجر به افزایش فعالیت کاتالیستی شود که تولید متانول را بهبود میبخشد.
گاز سنتزی که طی روشهای مختلفی تولید میشود، معمولا در محدوده ۲ = SN نبوده و معمولا با متوازن ساختن آن با CO۲ یا H۲ میزان آن را در محدوده ۲ نگه میدارند.
بازده فضا-زمان(STY)
برای ارزیابی فعالیت کاتالیستی در مورد کاتالیستهای متانول از شاخصی به نام بازده فضا-زمان استفاده میکنند. بازده فضا-زمان میزان محصول تولید شده در رآکتور با حجم مشخص، در زمان مشخص به ازای حجم یا حجم مشخصی از کاتالیست است. به عنوان مثال وقتی بازده فضا-زمان (STY) معادل ۶۰۰ باشد یعنی یک کیلوگرم کاتالیست تحت دما، فشار و حجم مشخصی از رآکتور با دبی مشخص، خوراک حدود ۶۰۰ گرم متانول تولید میکند. از آنجا که در تولید متانول هر سه گاز H۲، CO و CO۲ مصرف میشوند لذا معمولا به جای درصد تبدیل از شاخص STY که معیاری از تولید متانول است، استفاده میشود.
گزینش کاتالیست
در واکنش (۱-۱) جذب مونوکسید کربن بر سطح کاتالیست باید از نوع مولکولی، جذب دی اکسید کربن به صورت تفکیکی توأم با شکست C-O و جذب هیدروژن از نوع تفکیکی باشد.
جدول ۱) محصولات جانبی حاصل شده از هیدروژندار شدن مستقیم CO
| نسبت | واکنش |
| ۲/۱ | CO + 2H۲ methanol |
| ۱/۱ | 2CO + 2H۲ acetic acid |
| ۱/۱ | 2CO + 2H۲ methyl formate |
| ۲/۱ | 2CO + 4H۲ ethanol |
| ۲/۱ | 3CO + 6H۲ propanol |
| ۳/۲ | 2CO + 3H۲ ethylene glycol |
| ۲/۱ | 4CO + 8H۲ isobutanol |
| ۲/۱ | 2CO + 4H۲ ethylene |
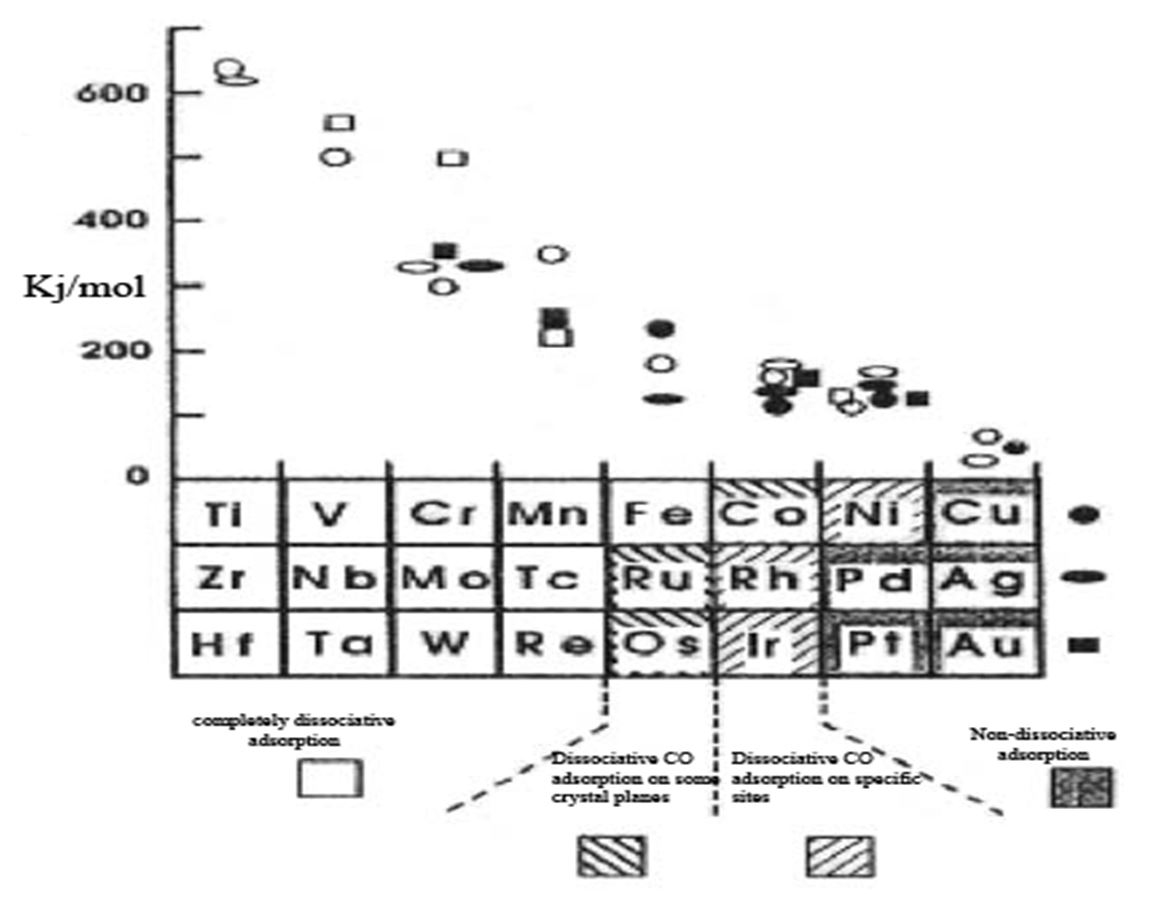
بنابراین برای تشکیل متانول از گاز سنتز، پیوند سیگمای کربن و اکسیژن روی سطح کاتالسیت نباید شکسته شود. همچنین کاتالیست نباید مولکول مونوکسید کربن را به طریقی فعال سازد که هیدروژناسیون از هر دو سر کربن و اکسیژن رخ دهد. علاوه بر آن کاتالیست باید به راحتی قادر به تفکیک پیوند H-H باشد و یکی از پیوندهای C-O در دی اکسید کربن را بشکند. شکل ۳زیر، تقسیمبندی فلزات را بر مبنای فعالیت آنها نسبت به جذب سطحی مونوکسید کربن نشان میدهد.
اگر آنتالپی جذب شیمیایی مونوکسید کربن از Kj/mol200 بیشتر باشد، جذب به صورت تفکیکی صورت میپذیرد (انرژی پیوند COبه اندازه Kj/mol360 است).
بنابراین با توجه به شکل زیر (نحوه جذب سطحی مولکول CO روی فلزات واسطه] جذب غیر تفکیکی مونوکسیدکربن تنها روی شش فلز پالادیوم، پلاتین، مس، ایریدیم، رودیم و طلا امکانپذیر است. از این میان طلا به علت عدم جذب هیدروژن از فهرست فلزات مناسب این واکنش حذف میگردد. بنابراین فلز مس به دلیل فعالیت مناسب، فراوانی و قیمت مناسب، به عنوان فلز فعال اصلی، گزینهای بسیار مناسب است. از طرفی فلز مس، پایداری حرارتی کمی دارد لذا برای بهبود پایداری حرارتی آن میتوان از اکسید فلزات پایداری نظیرAl۲O۳ و ZrO۲استفاده نمود. از طرفی جذب تفکیکی هیدروژن روی فلز مس ضعیف و روی دو فلز دیگر قوی است.
ضعیف بودن مرحله جذب هیدروژن روی فلز مس، باعث کند شدن واکنش کلی میگردد. برای جبران این نقص میتوان از فلزات واسطه یا قلیایی استفاده نمود که دارای خاصیت جذب قوی هیدروژن هستند.
وجود فلزات واسطه به جز دو فلز پالادیوم و رودیم باعث کاهش گزینشپذیری از طریق تولید متان (به علت جذب تفکیکی مونوکسید کربن روی آنها) یا تولید ترکیبات کربونیلدار (به علت کاهش پیوند برگشتی p ) میشود.
حضور فلزات قلیایی نیز واکنش را به سمت تولید الکلهای بالاتر و محصولات حاصل از تراکم آلدولی پیش میبرد. بنابراین حضور یک اکسید فلزی که جذب هیدروژن روی سطح آن قوی باشد، در ساختار ضروری است. پس مس و اکسید فلزی باید جایگاه (site) مشترکی تشکیل دهند که در آن مونوکسید کربن جذب مس و هیدروژن جذب اکسید فلزی گردد. سپس سر ریز (spill-over) هیدروژن روی اکسید فلزی انجام و هیدروژن حاصل در اختیار COجذب شده قرار میگیرد.
برای تشکیل این نوع سایت باید سنتز کاتالیست از طریق واکنش همرسوبی به گونهای صورت گیرد که در ساختار کریستالی پیش ماده، هر دو فلز وجود داشته باشد. کربناتها، نیتراتها و هیدروکسیدها برای تکلیس و تولید کاتالیست نهایی، پیشمادههایی مناسب هستند.
از آنجا که در واکنش سنتز متانول باید مولکول مونوکسید کربن یا دی اکسید کربن جذب جایگاه (site) گردد بنابراین اگر در مرحله ساخت کاتالیست (خشک کردن و تکلیس) مولکولی با ساختار مشابه واکنشگر از کاتالیست حذف شود، شعاع حفره های حاصل برای واکنش مناسبتر خواهد بود. لذا ساختار پیشماده سازنده باید یک هیدروکسی کربنات باشد که به روش همرسوبی حاصل می گردد. تنها ترکیبات روی، منیزیم، نیکل و کبالت، ترکیبات هیدروکسی کربنات دو فلزی با مس تولید می نمایند.
وجود نیکل و کبالت در کاتالیست به علت جذب تفکیکی مونوکسید کربن، نامطلوب است لذا تنها دو فلز منیزیم و روی باقی می ماند. حد واسطه های حاصل از این دو فلز در مرحله همرسوبی دارای فرمولاسیونهای Aurichalcite (Zn,Cu)۵(CO۳)۲(OH)۶، Mcguinnessite (Mg,Cu)۲(CO۳)(OH)۲، Zinc rosasite (Zn,Cu)۲(CO۳)(OH)۲ هستند.
بنابراین فلزات مذکور برای تقویت این واکنش باید مناسب باشند. از آنجا که مونوکسید کربن یک باز لوییس ضعیف است، تنها روی سطح فلزات با عدد اکسایش پایین (۱+ و ۰) جذب شیمیایی میشود. پس مس با عدد اکسایش ۲+ عملکرد کاتالیستی مناسبی برای سنتز متانول از گاز سنتز ندارد. از طرفی وجود بار مثبت روی سطح مس باعث میشود پیوند میان کربن-اکسیژن بیشتر تضعیف شود و واکنش با مونوکسید کربن راحتتر انجام گیرد.
بنابراین حضور مس با عدد اکسایش (۱+) در کاتالیست، واکنش را تقویت میکند. پس جایگاه مشترک باید متشکل از مس فلزی یا اکسید مس (I) همراه با اکسید منیزیم یا اکسید روی باشد. چندین دیدگاه در مورد طبیعت برهمکنش مس با اکسید فلزی مطرح است: ۱) مس در ساختار اکسید فلز وارد میشود و با توجه به سه ظرفیت محتمل برای آن در شبکه نقص کریستالی ایجاد مینماید یا اینکه با تشکیل آلیاژ سطحی باعث فعالیت کاتالیست میشود.
۲) صرفا فلز مس به تنهایی فعالیت را تعیین مینماید و اکسید فلزی به عنوان پایدار کننده، مساحت سطحی ویژه بالاتر را تضمین و تثبیت میکند.
۳) مس و اکسید فلزی، جایگاه مشترک ایجاد میکنند و باعث همافزایی فعالیت میگردند.
از میان نظریات فوق، نظریه ۲ و ۳ منطقیتر هستند. دو مکانیسم عمده در سنتز متانول مطرح است که یکی از مسیر مونوکسید کربن و دیگری از طریق دیاکسید کربن است. امروزه بسیاری از دانشمندان معتقدند که واکنش از طریق دیاکسید کربن پیش میرود. احتمالا مونوکسید کربن روی سطح مس (I) جذب میشود و هیدروژن در جایگاه اکسید فلزی به صورت ناهمگن جذب تفکیکی و به هیدرید تبدیل میشود و سر ریز (spill-over) آن روی مونوکسید جذب شده و تولید کاربن (carbene) مینماید. در مرحله بعد پروتون به کاربن حمله میکند و فرمالدهید تولید مینماید و در نهایت گونه متوکسی و متانول تشکیل میشود. اگر واکنش از طریق دی اکسید کربن پیش رود، از هیدروژناسیون CO۲ جذب شده، فرمات سطحی (HCOO*)حاصل میشود.
در این صورت به نظر میرسد مرحله تعیین کننده سرعت، هیدروژن کافت (hydrogenolysis) فرمات سطحی به متوکسی باشد. در مرحله بعد متوکسی سطحی با اتم هیدروژن جذب شده به متانول تبدیل میشود. اکسیژن جذب شده (O*) باقیمانده، بسته به شرایط واکنش به واسطه CO و H۲ حذف میگردد تا سطح برای ادامه واکنش و جذب دوباره CO۲ آماده گردد. این مکانیسم نیز مستلزم موجود بودن اکسیژن سطحی است تا تولید دیاکسید کربن را تقویت نماید. بنابراین لزوم حضور جایگاه مشترک مس (I) و اکسید فلزی، تایید می شود. مس در این ساختار میتواند عدد کئوردیناسیون ۲، ۴ و ۶ را بپذیرد. اکسیدهای روی و منیزیم نیز عدد کئوردیناسیون ۴، ۵، ۶ و ۸ را دارند. با این حال تنها باید به اعداد کئوردیناسیون مشترک یعنی ۴ و ۶ در این کاتالیست توجه شود. جدول۲، شعاع یونی هر یک از این فلزات را نشان میدهد.
همانگونه که ملاحظه میشود در عدد کئوردیناسیون ۶ اختلاف بین شعاع یونی کاتیونها زیاد است بنابراین احتمال تشکیل جایگاه مشترک کاهش می یابد و در عدد کئوردیناسیون، شعاع ها کاملا با یکدیگر برابر هستند و احتمال قرارگیری یکی در ساختار دیگری تقویت میشود. بنابراین اکسید روی به عنوان بهترین تقویتکننده به شمار میرود که طبعا به علت اهمیت آن در جایگاه مشترک، باید به مقدار زیاد در ترکیب کاتالیست قرار گیرد.
استفاده صنعتی از کاتالیست اکسید مس و اکسید روی نیز تاییدی بر صحت اصول تئوری بحث شده است. روش رسوبگیری همزمان نسبت به روش تلقیح برتری دارد زیرا در این روش اندازه کریستالها کاهش یافته، سطح ویژه و درصد فلز مس به سادگی قابل افزایش است. از سوی دیگر توده کاتالیست نیز در فعالیت کاتالیستی شرکت مینماید.
حضور سایر اکسیدهای فلزی که کاتیون آنها دارای عدد اکسایش بالاتر از ۲ است یا دارای عدد اکسایش برابر ۲ اما شعاعی متفاوت با روی و مس هستند، باعث ایجاد نقص در شبکه کریستالی میشود.
جدول ۲) شعاع و عدد کئوردیناسیون یونهای مس، روی و منگنز.
| یون | عدد کئوردیناسیون | شعاع (pm) |
| Cu+ | ۴ | ۷۴ |
| Cu+ | ۶ | ۹۱ |
| Zn۲+ | ۴ | ۷۴ |
| Zn۲+ | ۶ | ۸۸ |
| Mg۲+ | ۴ | ۷۱ |
| Mg۲+ | ۶ | ۸۶ |
اگر این نقص باعث تغییر ساختار شبکه نگردد، به علت افزایش تخلخل و سطح BET، باعث بهبود خواص کاتالیستی میشود.
کاتالیستهای همرسوبی CuO/ZnO/Al۲O۳
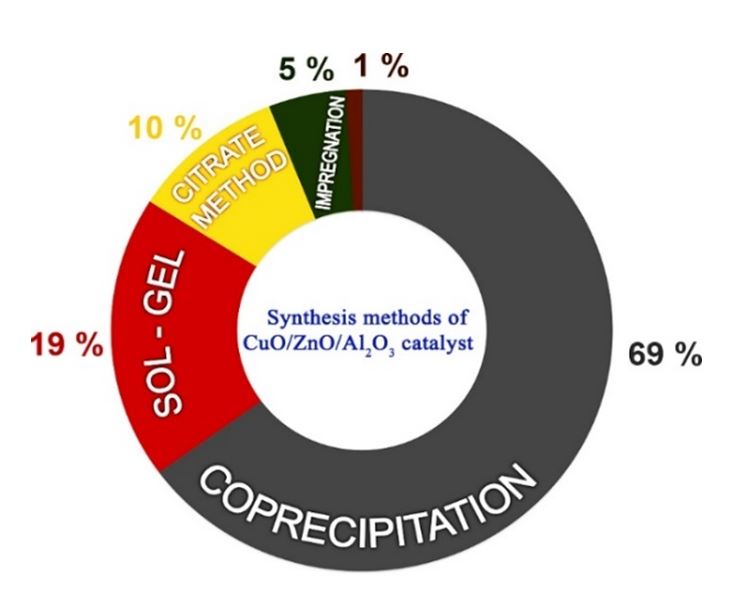
روش رسوبگیری همزمان یا همرسوبی، یکی از مهمترین روشهای تولید کاتالیستهای جامد است. با استفاده از این روش می توان به بافت بسیار همگنی از ذرات فعال و ریز کاتالیستی دست پیدا کرد که در روشهای دیگر چنین امکانی وجود ندارد. مزیت دیگر این روش، تنظیم دقیق استوکیومتری اجزای سازنده کاتالیست است. مرحله نهایی، ساخت کاتالیستها به روش همرسوبی تکلیس بوده و پس از آن کاتالیست شکلدهی میشود. یکی از مهمترین معایب این روش، تغییر در کیفیت کاتالیست است که برای رفع این مشکل معمولا رسوبگیری را در سیستمهای غیرپیوسته یا بچ انجام میدهند. شکل زیر (درصد روشهای مورد استفاده در سنتز کاتالیستهای سه جزئی طی ۱۰ سال) گراف مقایسهای درصد روشهای استفاده شده در سنتز کاتالیست سه جزئی CuO/ZnO/Al۲O۳ را طی ۱۰ سال نشان میدهد. به وضوح مشاهده میشود که روش همرسوبی، مهمترین و پرتکرارترین روش سنتز کاتالیست متانول است که بیشترین درصد را به خود اختصاص داده است.
همرسوبی، فرایندی پیچیده است که با هسته زایی اولیه آغاز شده و با رشد ذره و تشکیل نهایی رسوب، خاتمه مییابد. شکل زیر (فرایند هسته زایی در گذر زمان ) منحنی فرایند هسته زایی را نشان میدهد.
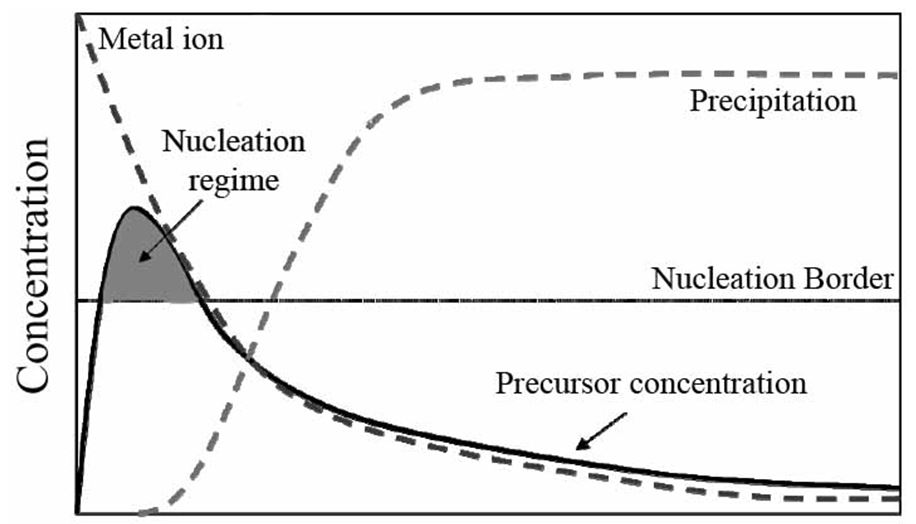
زمانیکه غلظت یون بیشتر از حد هسته زایی شود، تشکیل رسوب آغاز میشود و مادامی که غلظت واکنشگرها بالای مرز رسوبگیری باشند، هسته های جدید تشکیل میشوند.
زمانی که در اثر رسوبگیری، غلظت واکنشگرها پایینتر از مرز رسوبگیری شود، آنگاه هستهزایی متوقف گردیده و رشد ذره ادامه پیدا خواهد کرد. زمانی که میزان هسته زایی زیاد باشد آنگاه توزیع اندازه ذرات پهن خواهد شد.
تلاقی منحنی غلظت واکنشگرها و مرز رسوبگذاری، ناحیه هستهزایی را مشخص میکند. هر چه مساحت این ناحیه بیشتر باشد، اندازه ذرات تشکیل شده رسوب کمتر خواهد بود.
کاتالیستهای سه جزئی CuO/ZnO/Al۲O۳ به روش همرسوبی ساخته میشوند. در این روش محلول آبی نیتراتهای فلزی مس و روی و آلومینیوم به وسیله کربنات سدیم در دمای بین ۵۰ تا ۹۰ درجه سلسیوس و pH بین ۵/۶ تا ۹ رسوب داده میشود. پس از رسوبگیری حدود یک ساعت پیرسازیصورت میگیرد.
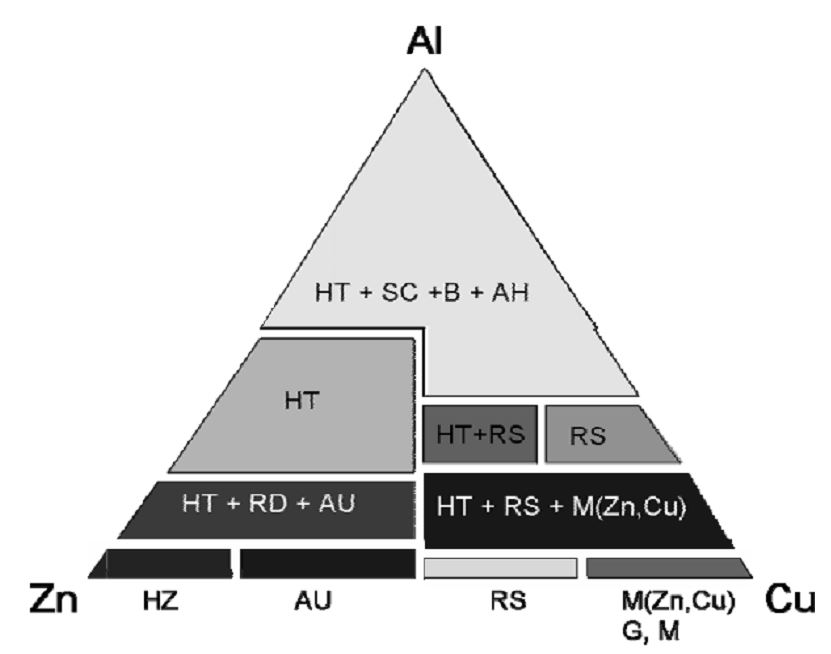
بسته به شرایط واکنش، فاز یا فازهای بلوری مختلفی نظیر کربناتها، هیدروکسی کربناتها، هیدروکسی نیتراتها، هیدروکسیها یا اکسیدهای فلزی تشکیل میشوند. جدول ۳فازهای متنوع تشکیل شده در حین فرایند رسوبگیری را نشان میدهد. شکل زیر (دیاگرام انواع فازهای هیدروکسی-کربناتی قابل تشکیل در سیستم سه فلزی حین سنتز کاتالیست متانول) به طور شماتیک فازهای تشکیل شده در حین سنتز کاتالیستهای سه جزئی را با توجه به میزان فلز، نشان میدهد.
لازم به توضیح است بسته به مقدار عناصر تشکیلدهنده، فاز یا فازهای متفاوتی در محصول به وجود میآید. با توجه به اینکه قسمت اعظم این کاتالیستها را اکسید مس تشکیل میدهد، ساختار شبه هیدروتالسیت(CuxZn۱-x)۶Al۲(OH)۶CO۳.4H۲O]]، زینک مالاکیت [(Cu۱-xZnx)۲(OH)۲CO۳] با x < 0.3 و روزاسیت [(Cu۱-xZnx)۲(OH)۲CO۳] با ۰.۵ < x < 0.3 در این کاتالیستها تشکیل میشود.
حال این سوال مطرح میشود که فعالترین فاز برای تشکیل کاتالیستی با فعالیت و گزینش پذیری بالا، کدام است؟
جدول ۳) تشکیل فازهای متنوع هیدورکسی کربناتی در حالتهای مختلف
| Al | Zn | Cu | تک فلزی |
| Al(OH)۳, Aluminum hydroxide (AH)
AlOOH, Boehmite(B) Al(OH)۳Al۲(CO۳)۳ Scarborite (SC)
|
Zn۵(OH)۶(CO۳)۲, Hydrozincite (HZ)
Zn۴(OH)۶CO۳.H۲O, Zinc-hydroxycarbonate Zn(OH)۲, Zinc Hydroxide |
Cu۲(OH۲) CO۳, Malachite (M)
Cu۲(OH۲) NO۳, Gerhardit (G) |
|
| (CuxZn۱-x)۵(OH)۶(CO۳)۲, Cu-Hydrozincite HZ (Cu, Zn) for x ˂ ۰.۱۵, Aurichalcite (AU) for 0.۲۷ ˂ x ˂ ۰.۴۵ |
|||
(Cu۱-xZnx)۲(OH)۲CO۳, Zn-Malachite M (Cu, Zn) for x < 0.3, Rosasite (RS) for 0.3 ˂ x ˂ ۰.۵
(Cu, Zn)۳(CO۳)(OH۴).4H۲O Claraitدو فلزی
(CuxZn۱-x)۶Al۲(OH)۶CO۳.4H۲O, Hydrotalcite like (HT) for x ˂ ۰.۵
(Cu, Zn, Al) Hydroxycarbonate
(CuxZn۱-x)۱۶Al۲(OH)۶(CO۳)۲, Roderit (RD)
فلزات کاتالیستهای دو جزئی CuO/ZnO
زینک مالاکیت، عامل تشکیل فاز فعال
عامل مشابه در کاتالیستهای سه جزئی: مخلوطی از ساختار شبه هیدروتالسیت و روزاسیت
دلیل فعالیت بالای فازهای مذکور، جایگزینی درصدی از اتمهای مس با اتمهای روی در شبکه بلوری هیدروکسی کربنات حاصل است.
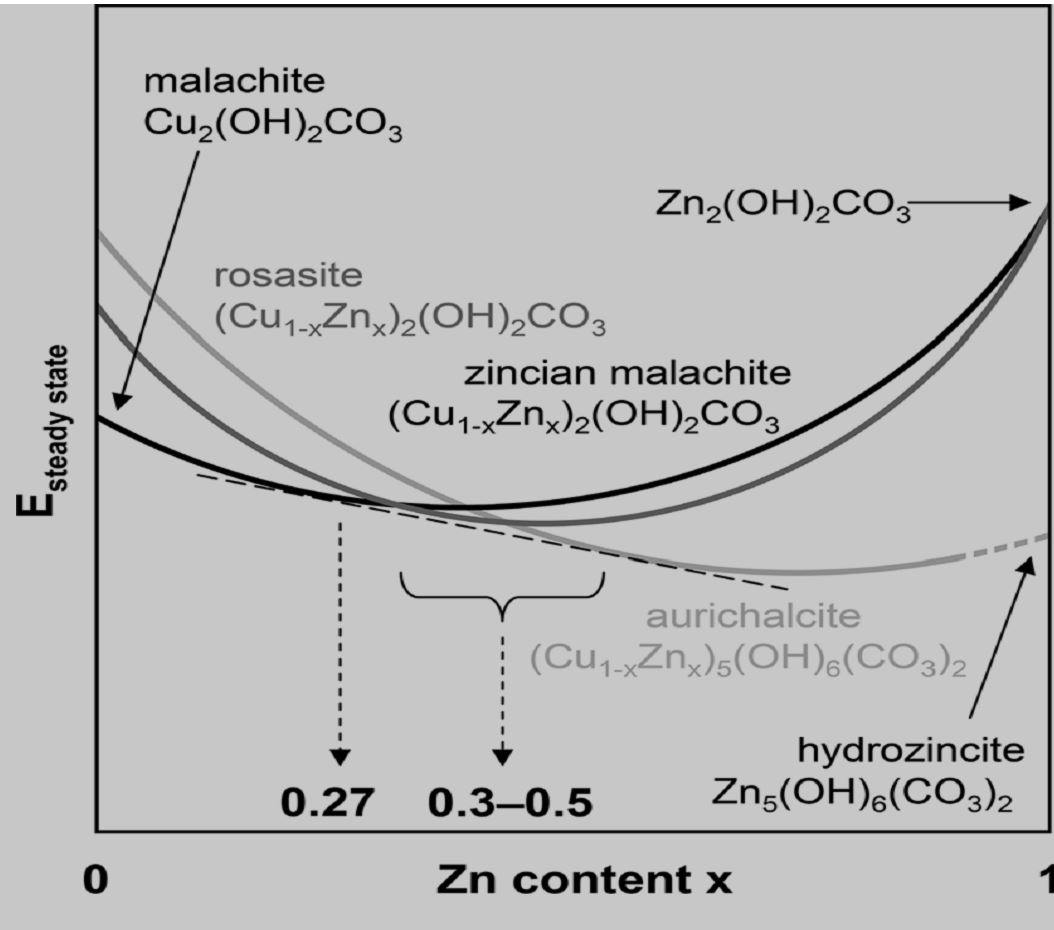
این جایگزینی باید در حد مطلوبی نگاه داشته شود تا فعالیت و گزینشپذیری کاتالیست حفظ شود. برای دستیابی به فاز مطلوب باید نسبت Cu:Zn در محدوده مشخص و دقیقی حفظ شود.
شکل زیر (تشکیل فازهای مختلف هیدروکسیکربناتی بر حسب کسر مولی روی. تشکیل فازهای مطلوب روزاسیت و زینک مالاکیت در بازه ۵/۰ > x > 27/0 به لحاظ انرژی مطلوب میشود) محدوده تشکیل هیدروکسی کربناتهای دوتایی فلزات روی و مس را نشان میدهد.
همانطور که در شکل زیر دیده میشود، در هر نسبتی از Cu و Zn، تشکیل فاز کریستالی خاصی به لحاظ انرژی مطلوب میشود. روزاسیت و زینک مالاکیت فرمول تقریبا یکسانی دارند اما میزان روی موجود در روزاسیت کمی بیشتر است. کنترل دقیق نسبت Cu و Zn برای به دست آوردن فاز مطلوب ضروری است و خارج از محدوده بهینه فازهای نامطلوب دیگری تشکیل خواهند شد.
البته باید متذکر شد با اینکه جایگزینی اتمهای مس با اتمهای روی در شبکه بلوری هیدروکسی کربنات منجر به افزایش فعالیت کاتالیست میشود اما جایگزینی بیش از حد اتمهای مس با اتمهای روی منجر به تشکیل فاز نامطلوب اوریکلسیت شده و با اینکه این فاز از نظر تعداد اتمهای روی در شبکه کریستالی غنیتر است اما محصول نهایی، کاتالیستی با فعالیت و گزینشپذیری به مراتب پایینتر خواهد بود.
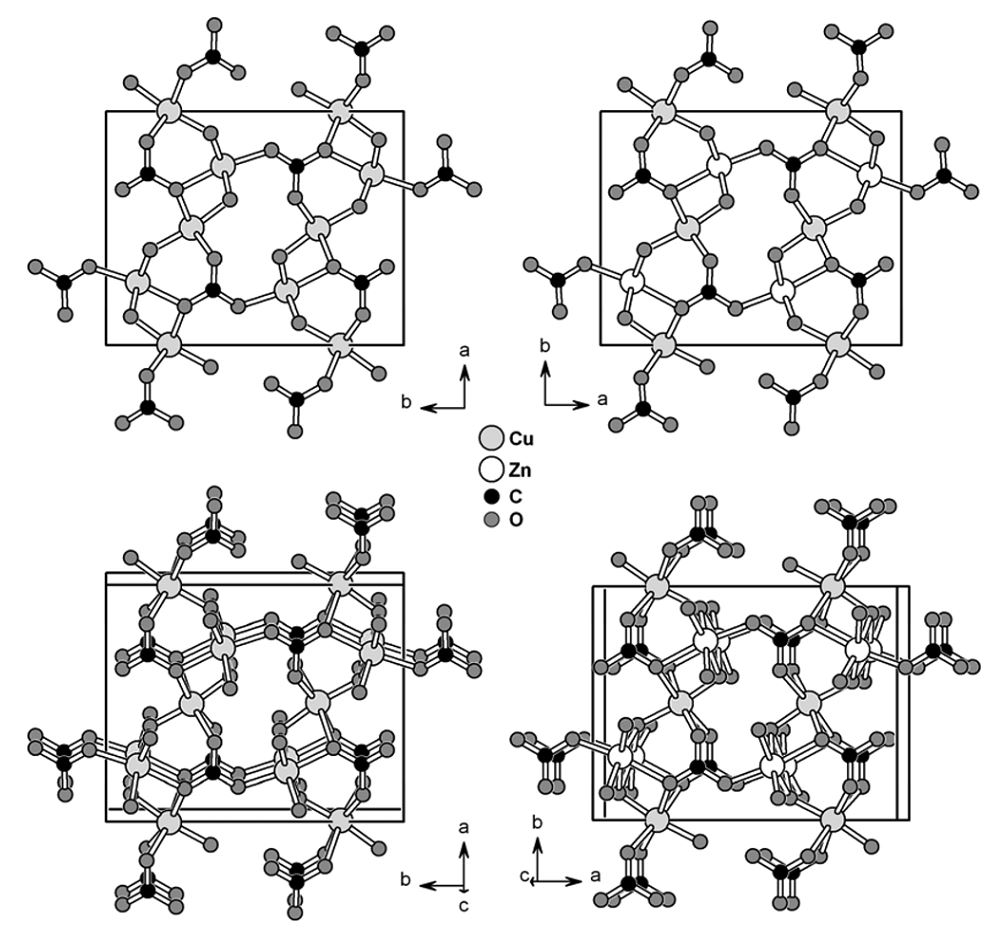
میزان جایگزینی اتمهای روی در شبکه با استفاده از فاصله بین دسته صفحات بلوری قابل محاسبه است. برای درک بهتر، میتوان با مراجعه به سلولهای واحد دو ساختار مالاکیت خالص که تنها فلز آن مس است و سلول واحد روزاسیت که در آن قسمتی از اتمهای مس با روی جایگزین شده است، اختلاف دو ساختار را به دست آورد.
شکل زیر (ساختارهای کریستالی مالاکیت خالص (سمت چپ) و روزاسیت (سمت راست). تصویر بالا زاویه دید در جهت [۰۰۱] است اما در تصاویر پایین، زاویه دید کمی در جهت صفحه (۰۰۱) منحرف شده است.) سلول واحد مالاکیت خالص و روزاسیت را نشان میدهد. اجزای اصلی سازنده در مالاکیت CuO۶ و در مالاکیت (Cu,Zn)O۶ هستند. زمانی که از جهت [۰۰۱] به دو ساختار نگریسته شود، دو ساختار کاملا یکسان به نظر میرسند (تصاویر بالایی ) اما اگر زاویه دید کمی به سمت صفحه (۰۰۱) منحرف شود، آنگاه تفاوت دو ساختار آشکار خواهد شد.
در تصاویر شکل زیر مشاهده میشود که در ساختار روزاسیت زوایای منوکلینیکی نسبت به ساختار مالاکیت خالص کمی تغییر داشتهاند. از آنجا که Cu۲+ آرایش الکترونی نامتقارن دارد لذا انحراف یان-تلر در واحدهای CuO۶ ساختار مالاکیت خالص قابل انتظار است. با جایگزین شدن بخشی از اتمهای مس با اتمهای روی در ساختار روزاسیت، این انحراف کاهش یافته و کاهش در پارامترهای سلول واحد شبکه کریستالی قابل انتظار است.
با توجه به مطالب ذکر شده از کاهش فواصل بین شبکه ای (d) نسبت به ساختار مالاکیت خالص، میتوان به معیاری برای جایگزینی اتمهای مس با اتمهای روی دست یافت. این موضوع در شکل زیر (ارتباط بین میزان جایگزینی اتمهای روی با اتمهای مس و کاهش در ساختار مالاکیت و سطح ویژه فلز فعال مس) قابل رؤیت است.
با توجه به شکل زیر زمانی که درصد روی به ۲۸ درصد میرسد، بیشترین کاهش در و بیشترین افزایش در سطح ویژه فلز فعال مس را شاهد خواهیم بود.
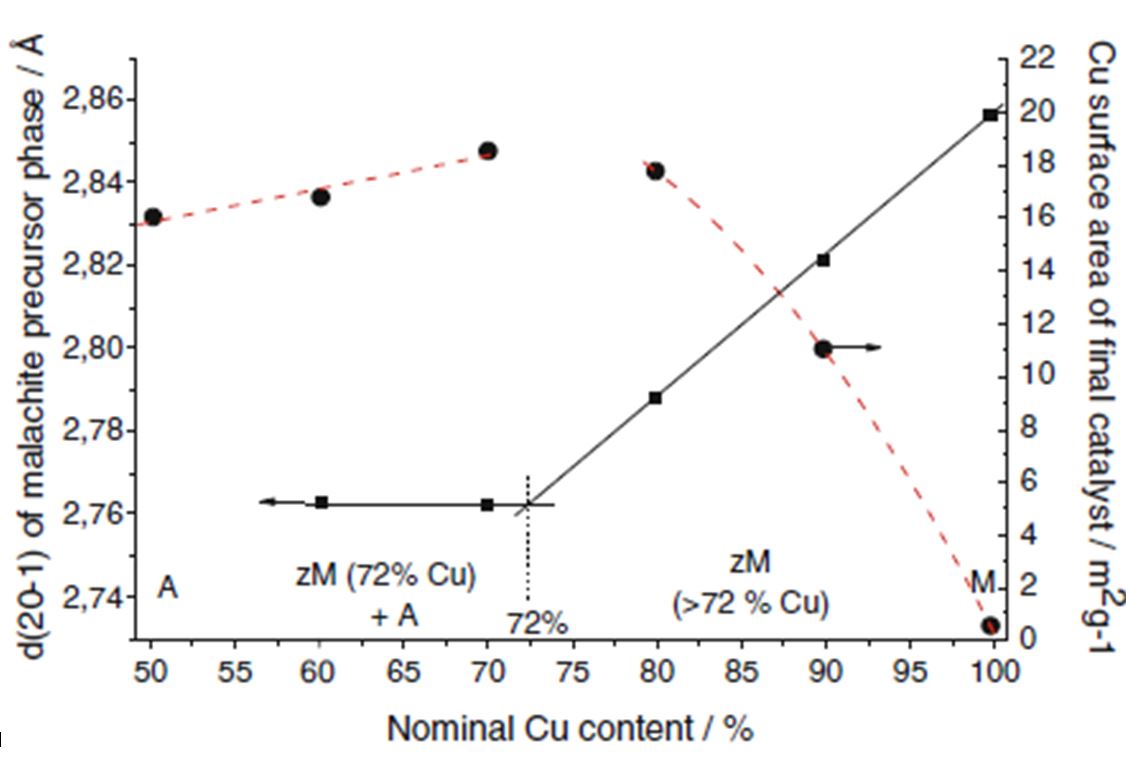
در مقادیر بالاتر از ۲۸ درصد، مازاد روی به صورت هیدروزینسیت رسوب میکند. شایان ذکر است که علاوه بر اینکه نسبت اتمها باید در یک محدوده بهینه حفظ شود، شرایط ساخت نمونه از قبیل دما، pH، دما و زمان کهنهسازی نیز در فعالیت و گزینش پذیری کاتالیست بسیار تاثیرگذار است.
بیلتز مطالعه جامعی در خصوص شرایط سنتز مطلوب انجام داده است و به این نتیجه رسیده که بهترین کاتالیست در ۷ = pH، دمای رسوبگیری ۶۰ درجه سلسیوس و دمای کهنه سازی ۷۰ درجه سلسیوس به مدت یک ساعت سنتز میشود.

غیر فعال شدن کاتالیست
مطالعات دقیق محققان در سالهای اخیر در خصوص نحوه غیر فعال شدن این کاتالیستهای سه جزئی، سه عامل را در افت فعالیت تدریجی این کاتالیستها دخیل میداند: ۱) به هم چسبیدگی ذرات فعال فلز مس ۲) مهاجرت ذرات ZnO و حرکت به سوی یکدیگر و کلوخه شدن و ۳) اکسید شدن تدریجی ذرات مس فلزی
هر سه عامل مذکور متاثر از شرایط عملکردی هستند. عامل اصلی به هم چسبیدگی ذرات مس، دمای بالا و مقادیر بالای آب است. حضور مقادیر بالاتر آب موجب درشت شدت ذرات فعال مس میشود.
از آنجا که مس در دماهای بالاتر از ۳۰۰ درجه سلسیوس شروع به کلوخه شدن میکند و در شرایط واکنش، دما بالاتر از ۲۵۰ درجه سلسیوس نمیرود، این عامل در شرایط عملیاتی احتمال ضعیفتری دارد و این پدیده در مدت زمانی طولانی و به تدریج اتفاق میافتد.
همچنین انجام واکنش متانیشن که واکنشی شدیدا گرمازا است، موجب افزایش دما و به هم چسبیدگی ذرات مس میگردد. عامل بعدی، مهاجرت ذرات ZnO و حرکت به سوی یکدیگر و کلوخه شدن آنها است. محققان دو عامل را دخیل در این موضوع میدانند: اول اینکه در حضور هیدروژن مقداری از ZnO به Zn احیا شده و با Cu تشکیل آلیاژ برنج داده و مقداری از سطح فعال کاتالیست از دست میرود. عامل دوم مربوط به حضور گاز اکسنده دیاکسید کربن است.
اخیرا دانشمندان متوجه شدهاند که حضور گاز CO۲، مهاجرت ذرات ZnO را تسریع میبخشد. علاوه بر این، گاز CO۲ موجب اکسیداسیون بیشتر کریستالهای فعال Cu و تبدیل آنها به CuO میشود. در این مورد افت فعالیت کاتالیستی شدیدتر خواهد بود چرا که مستقیما روی هر دو ذره Cu و ZnO تاثیر میگذارد. این موضوع در شکل زیر (تاثیر CO۲ بر کلوخه شدن ZnO و اکسیداسیون Cu) به تصویر کشیده شده است.
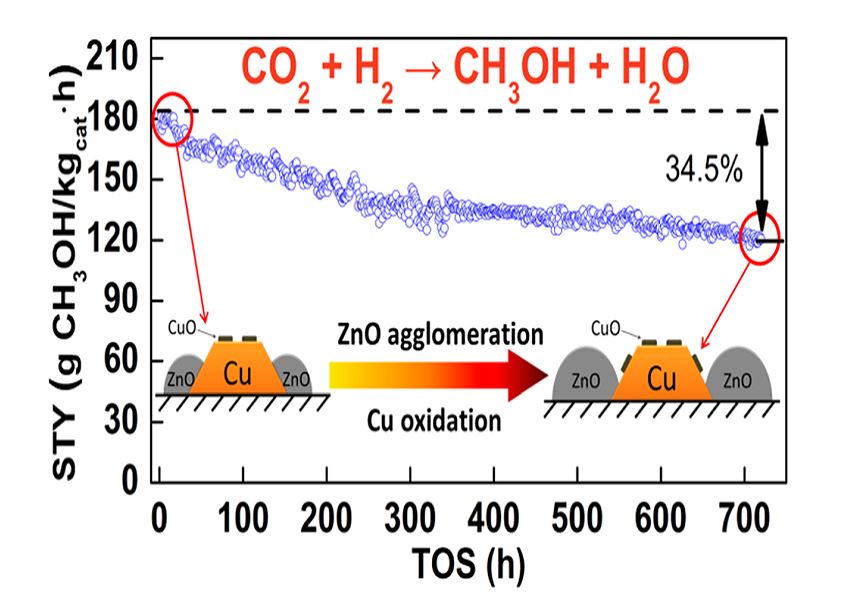
برای کاهش اثرات CO۲، دو اقدام میتوان انجام داد: اولین اقدام ایجاد ساختارهای مناسب در کاتالیست برای مهار مهاجرت ذرات به سوی یکدیگر از طریق ایجاد ماتریکسی آمورف است که این موضوع در سطح اتمی اتفاق میافتد و باید در شیوه ساخت کاتالیست اعمال شود. تصویر زیر (دو ماتریکس متفاوت از کاتالیستهای سنتز متانول) این موضوع را نشان میدهد.

ذرات محصور شده در ماتریکس آمورف با بلورینگی ناچیز، مهارشدگی کریستالهای Cu و ZnO را افزایش میدهد. این مهم با انتخاب روش سنتز مناسب حاصل میشود. عامل دوم مربوط به شرایط عملیاتی است. مطابق تحقیقات انجام شده، مشخص گردیده که مطلوبترین میزان CO۲ در خوراک باید بین ۴ تا ۸ درصد باشد. بالاتر از این مقادیر، فعالیت کاتالیست افت میکند و کاتالیست به صورت برگشتناپذیر، غیرفعال میشود.
نظر خود را درباره این مقاله برای مان بنویسید.
تجربیات خود در تولید آزمایشگاهی و یا استفاده صنعتی آن کاتالیست سنتز متانول را با ما به اشتراک بگذارید.

دستیار هوش مصنوعی
دیدگاهتان را بنویسید